... cordialmente! mc
venerdì 22 dicembre 2017
domenica 10 dicembre 2017
Una visita tanto attesa!
Mentre questi tre giorni di pausa stanno per cessare, vi partecipo la mia felicità per una visita che ho ricevuto: quella di Mattia Cettolin, giovane e grande Chimico e soprattutto grande Amico.
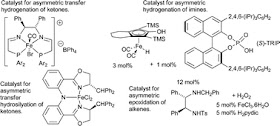
Mattia sta concludendo il dottorato di ricerca in Chimica presso l'Università di Milano dove si è occupato di Catalisi (beato lui...).
Lo schema soprastante rappresenta la reazione di idrogenazione dell'acetofenone a 1-fenil-etanolo. Il prodotto può esistere in due forme enantiomeriche, ossia - approssimando un poco - con due geometrie speculari, come la mano destra e la mano sinistra, immagine che avevamo visto tempo addietro per molti altri composti di origine naturale (come zuccheri e amminoacidi) e di sintesi.
E' possibile, mediante un opportuno catalizzatore, ottenere prevalentemente (o quasi esclusivamente) solo una delle due forme. Ciò riveste un notevole interesse nell'industria della chimica fine, soprattutto nei settori farmaceutico, agrofarmaceutico e cosmetico (es. fragranze).
Per realizzare la reazione (oppure altre simili) si impiegano ora catalizzatori a base di metalli nobili (Ru, Rh, Pd, Ir...), assai costosi. Alcuni settori della ricerca chimica si impegnano a sviluppare catalizzatori a base di metalli di transizione più comuni e più economici, come ad esempio il ferro. Magari i leganti che occorrono per formare i complessi catalitici non sono poi tanto economici, ma procediamo oltre.
La mia conoscenza di tali settori e dei risultati è solo teorica (a differenza di quella di Mattia, che invece si è potuto immergere anima e corpo, sporcando reattori e provette) e personalmente la devo in larga parte ad un bellissimo corso, tenuto dal prof. Scarso e seguito da me ormai qualche anno fa: QUI trovate qualche informazione in più.
Affascinato da tutto ciò che è catalisi, ho continuato a seguire le pubblicazioni anche sul ferro e sui suoi composti: ne ho accennato nel mio libro - che spero di riuscire a presentare, prima o poi... ma questa è un'altra storia. Intanto ho avuto il piacere di regalarne finalmente una copia a Mattia, dopo tanto tempo!
venerdì 8 dicembre 2017
Per la cronaca: il tallio.
In questi giorni, sulle cronache nazionali si legge dell'arresto di un giovane, accusato di aver avvelenato i nonni e la zia con il solfato di tallio, una sostanza usata un tempo per confezionare rodenticidi.
Sui giornali è riportato il profilo, un po' fuori dagli schemi, di questa persona; qualche ammiccamento ad Agatha Christie in "Un cavallo per la strega" e niente più.
Mi aspettavo, francamente, un riferimento a un film del 1995, poco conosciuto in Italia, dal titolo: "Il manuale del giovane avvelenatore" (The young poisoner's handbook).
La trama di questo film è imperniata sulla vita di Graham Young, appassionato di chimica fin da bambino (immancabile, nel film, la scatola del piccolo chimico e qualche collegamento a Zio Tungsteno nelle descrizioni di esperimenti e drogherie), trascurato dal padre e in conflitto con la matrigna.
Graham, dopo l'ennesimo litigio con la donna, decise di avvelenarla usando sali di antimonio e di tallio. Con un po' di british black humor, il film evidenzia i sintomi dell'avvelenamento da tallio (danni al sistema nervoso periferico e centrale) e scherza (all'inglese!) sulla perdita dei capelli. Oltre alla matrigna, Graham uccise anche altre persone: dopo una prima condanna al manicomio criminale, terminò i suoi giorni in carcere, ucciso da un compagno di cella.
Oltre a Graham Young, un'altra serie di avvelenamenti col tallio fu realizzata da Martha Marek, la quale spedì all'altro mondo il marito, un parente, una sua pensionante e la di lei figlia di soli nove mesi. Il 6 dicembre 1938 la Marek fu ghigliottinata per i suoi orrendi crimini: Hitler, che da poco aveva annesso l'Austria al Reich, aveva appena reintrodotto la pena capitale.
Il tallio (Tl), elemento del gruppo del boro, ha Z=81. Fu scoperto da Crookes nei fanghi residui delle camere di piombo e deve al suo nome al colore verde germoglio (= thallos, in greco) di una riga caratteristica osservata sullo spettro.
Forma prevalentemente composti monovalenti: lo ione Tl+ è, negli organismi viventi, vicariante del catione potassio (e per questo esplica la sua azione tossica). Presenta molte caratteristiche simili a quelle dei metalli alcalini: si ossida facilmente all'aria, in acqua forma idrossido talloso, TlOH.
La sua chimica si spiega con la perdita dell'unico elettrone alloggiato in un orbitale p, mentre con più difficoltà perde i due elettroni negli orbitali s per dare il catione trivalente: dal 1927 fu introdotta da Sidgwick l'espressione "coppia inerte" per indicare questo fenomeno (e non tanto la sua spiegazione), dovuto agli orbitali d, agli orbitali f (contrazione lantanidica) e a effetti relativistici. [1] Altri autori chiamano in causa spiegazioni più complesse, giustificate sempre con effetti relativistici.
[1] A. F. Holleman; E. Wiberg, Inorganic Chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
giovedì 7 dicembre 2017
Il "genetliaco" di una passione...
Per i bambini delle zone dove risiedo, il giorno di San Niccolò (6 dicembre, memoria liturgica di San Nicola, vescovo di Mira) è tanto atteso quanto speciale.
Il vescovo, con la lunga barba bianca, accompagnato dal suo asinello, si annuncia al suono di una campanella: i bambini vanno a letto e, al risveglio, trovano in cucina (o in salotto) qualche pacco dono da scartare. O magari del carbone (dolce...!) se sono stati birichini...
Il 6 dicembre 1987, esattamente 30 anni fa, ho trovato sul tavolo della cucina questa cosa qui (beh... l'immagine è presa dal web, di quello mio resta ben poco):
Mi chiedo se il mio interesse per la chimica e per le scienze naturali sia nato qui (vorrei rispondere con un convinto "si", ma devo concedermi il beneficio del dubbio), anche se poi si è spento negli anni delle superiori (meglio che non scriva il perché).
Il mio interesse per questa materia si è risvegliato anni dopo e in un contesto che ancor oggi mi sorprende, quando ci ripenso: al termine di un seminario di cinque lezioni sulle meridiane, tenuto da un sacerdote che per una vita ha insegnato scienze naturali in un liceo paritario della mia città, mentre attendevo agli studi di filosofia e di teologia (che ho concluso da laico, anche se per qualche mente eletta comunque "puzzo troppo da prete per fare carriera accademica"...).
Avendo la disponibilità economica e mosso da forti motivazioni, ho deciso di tentare di studiare la chimica in modo più rigoroso e il resto è storia (più o meno) nota.
Oggi insegno felicemente questa materia in una scuola paritaria e sono felice di poter condividere questa mia passione con gli studenti. Spero che il tentativo sia apprezzato anche da loro.
domenica 3 dicembre 2017
CLAIR DE LUNE...
Ammirando dalla finestra il sorgere della luna, ieri sera, mi sembrava di ascoltare Debussy mentre componeva il celeberrimo terzo movimento della Suite bergamasca...
venerdì 1 dicembre 2017
POSTILLE A UNA CONFERENZA
Al termine dell'ultima mia conferenza di quest'anno, tenuta il 30 novembre a Pieve d'Alpago, ospite della sezione locale dell'Auser, ho avuto il piacere di conoscere un signore che ha lavorato in Svizzera, per ben trentasei anni, nel settore carpenterie metalliche di un'importante industria chimica, la Lonza. Con il signore di cui sopra e altre persone ho continuato la conversazione al Bar Centrale, dove - tra le tante cose - si degusta un ottimo gelato artigianale.
Lonza, fornitore leader di prodotti per la farmaceutica, per la sanitaria e per le scienze della vita, ha celebrato quest'anno i 120 anni dalla fondazione. L'azienda nacque nel 1897 a Gampel, nel Canton Vallese, sulle rive del fiume omonimo.
Inizialmente l'azienda produceva elettricità in una piccola centrale idroelettrica, usata per fabbricare carburo di calcio: la miscela di calcare e carbone reagiva in un forno ad arco elettrico, capace di raggiungere le elevate temperature (oltre i 2000°C) necessarie alla sintesi. Il carburo usciva dal forno allo stato fuso, si raffreddava e solidificava.
Inizialmente l'azienda produceva elettricità in una piccola centrale idroelettrica, usata per fabbricare carburo di calcio: la miscela di calcare e carbone reagiva in un forno ad arco elettrico, capace di raggiungere le elevate temperature (oltre i 2000°C) necessarie alla sintesi. Il carburo usciva dal forno allo stato fuso, si raffreddava e solidificava.
Qualche anno dopo, Lonza si stabilì a Visp, dove si espanse e da azienda produttrice di elettricità divenne leader nel settore chimico: nel 1909 cominciò la produzione di concimi azotati (ammoniaca), nel 1920 quella di acido nitrico e di altri derivati dell'acetilene (acetaldeide, acido acetico, cloruro di vinile, etc.).
L'acetilene fu per qualche decennio un intermedio importante, non solo alla Lonza ma in molti altri stabilimenti chimici: oggi conosce una nuova attualità, come racconta QUI il professor Giorgio Nebbia.
Per produrlo bastavano calcare e carbone da cui si otteneva il carburo di calcio, come sopra ricordato: calcare e carbone (di legna) abbondano come risorse naturali in montagna, assieme all'acqua dolce e questo potrebbe aver favorito la nascita dell'industria chimica in montagna, almeno in un primo tempo.
Come scoprì Wohler mezzo secolo prima, carburo di calcio e acqua reagiscono per formare acetilene e un residuo inutilizzabile (almeno allora: ora si usa come base per fabbricare cemento). La stessa reazione era sfruttata nelle lampade da minatore e oggi nelle lampade da speleologo.
Dall'acetilene, mediante reazioni catalizzate da sali di mercurio, di rame o di zinco, si ottenevano prodotti necessari alla sintesi dei monomeri vinilici, usati per produrre le prime materie plastiche (PVC, poliacetati) e le fibre tessili sintetiche (acriliche).
L'acetilene fu per qualche decennio un intermedio importante, non solo alla Lonza ma in molti altri stabilimenti chimici: oggi conosce una nuova attualità, come racconta QUI il professor Giorgio Nebbia.
Per produrlo bastavano calcare e carbone da cui si otteneva il carburo di calcio, come sopra ricordato: calcare e carbone (di legna) abbondano come risorse naturali in montagna, assieme all'acqua dolce e questo potrebbe aver favorito la nascita dell'industria chimica in montagna, almeno in un primo tempo.
Come scoprì Wohler mezzo secolo prima, carburo di calcio e acqua reagiscono per formare acetilene e un residuo inutilizzabile (almeno allora: ora si usa come base per fabbricare cemento). La stessa reazione era sfruttata nelle lampade da minatore e oggi nelle lampade da speleologo.
Dall'acetilene, mediante reazioni catalizzate da sali di mercurio, di rame o di zinco, si ottenevano prodotti necessari alla sintesi dei monomeri vinilici, usati per produrre le prime materie plastiche (PVC, poliacetati) e le fibre tessili sintetiche (acriliche).
Dal 1965, l'acetilene fu sostituito con la nafta di petrolio (uno scarto di raffineria impiegato, previa desolforazione, come solvente e come carica per cracking) in qualità di materiale di partenza per il settore organico. Da essa, l'azienda produce tuttora intermedi per l'industria farmaceutica e agrofarmaceutica, per il settore alimentare, per l'industria degli adesivi, etc.
Il signore mi raccontava della sua esperienza nel lavorare i metalli, acquisita sul campo, dentro la fabbrica: nella città natale aveva imparato un po' il mestiere, ma si trattava di lavorare comune lamiera. Nello stabilimento svizzero si è trovato a dover lavorare il tantalio, lo zirconio, l'hastelloy (una lega a base di nichel resistente alla corrosione e usata per fare impianti).
Raccontava del reparto dove, da mercurio metallico, si produceva un tempo l'ossido di mercurio da introdurre nel reattore per la sintesi dell'acetaldeide. Schematizzando:
Raccontava del reparto dove, da mercurio metallico, si produceva un tempo l'ossido di mercurio da introdurre nel reattore per la sintesi dell'acetaldeide. Schematizzando:
- l'ossido di mercurio, nel reattore, reagisce con l'acido solforico in soluzione acquosa diluita per dare solfato di mercurio;
- il solfato mercurico catalizza l'idratazione dell'acetilene ad acetaldeide;
- in uno stadio successivo, l'acetaldeide è poi ossidata per dare acido acetico.
Ho ascoltato con piacere questi frammenti, contrappuntati da qualche digressione sulla vita operaia e di emigrante. Chissà che l'acetilene e le sue antiche (e future, a quanto pare) lavorazioni non possano diventare l'argomento di un prossimo incontro.