... cordialmente! mc
venerdì 22 dicembre 2017
domenica 10 dicembre 2017
Una visita tanto attesa!
Mentre questi tre giorni di pausa stanno per cessare, vi partecipo la mia felicità per una visita che ho ricevuto: quella di Mattia Cettolin, giovane e grande Chimico e soprattutto grande Amico.
Mattia sta concludendo il dottorato di ricerca in Chimica presso l'Università di Milano dove si è occupato di Catalisi (beato lui...).
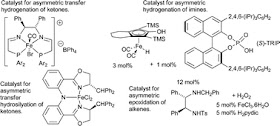
Lo schema soprastante rappresenta la reazione di idrogenazione dell'acetofenone a 1-fenil-etanolo. Il prodotto può esistere in due forme enantiomeriche, ossia - approssimando un poco - con due geometrie speculari, come la mano destra e la mano sinistra, immagine che avevamo visto tempo addietro per molti altri composti di origine naturale (come zuccheri e amminoacidi) e di sintesi.
E' possibile, mediante un opportuno catalizzatore, ottenere prevalentemente (o quasi esclusivamente) solo una delle due forme. Ciò riveste un notevole interesse nell'industria della chimica fine, soprattutto nei settori farmaceutico, agrofarmaceutico e cosmetico (es. fragranze).
Per realizzare la reazione (oppure altre simili) si impiegano ora catalizzatori a base di metalli nobili (Ru, Rh, Pd, Ir...), assai costosi. Alcuni settori della ricerca chimica si impegnano a sviluppare catalizzatori a base di metalli di transizione più comuni e più economici, come ad esempio il ferro. Magari i leganti che occorrono per formare i complessi catalitici non sono poi tanto economici, ma procediamo oltre.
La mia conoscenza di tali settori e dei risultati è solo teorica (a differenza di quella di Mattia, che invece si è potuto immergere anima e corpo, sporcando reattori e provette) e personalmente la devo in larga parte ad un bellissimo corso, tenuto dal prof. Scarso e seguito da me ormai qualche anno fa: QUI trovate qualche informazione in più.
Affascinato da tutto ciò che è catalisi, ho continuato a seguire le pubblicazioni anche sul ferro e sui suoi composti: ne ho accennato nel mio libro - che spero di riuscire a presentare, prima o poi... ma questa è un'altra storia. Intanto ho avuto il piacere di regalarne finalmente una copia a Mattia, dopo tanto tempo!
venerdì 8 dicembre 2017
Per la cronaca: il tallio.
In questi giorni, sulle cronache nazionali si legge dell'arresto di un giovane, accusato di aver avvelenato i nonni e la zia con il solfato di tallio, una sostanza usata un tempo per confezionare rodenticidi.
Sui giornali è riportato il profilo, un po' fuori dagli schemi, di questa persona; qualche ammiccamento ad Agatha Christie in "Un cavallo per la strega" e niente più.
Mi aspettavo, francamente, un riferimento a un film del 1995, poco conosciuto in Italia, dal titolo: "Il manuale del giovane avvelenatore" (The young poisoner's handbook).
La trama di questo film è imperniata sulla vita di Graham Young, appassionato di chimica fin da bambino (immancabile, nel film, la scatola del piccolo chimico e qualche collegamento a Zio Tungsteno nelle descrizioni di esperimenti e drogherie), trascurato dal padre e in conflitto con la matrigna.
Graham, dopo l'ennesimo litigio con la donna, decise di avvelenarla usando sali di antimonio e di tallio. Con un po' di british black humor, il film evidenzia i sintomi dell'avvelenamento da tallio (danni al sistema nervoso periferico e centrale) e scherza (all'inglese!) sulla perdita dei capelli. Oltre alla matrigna, Graham uccise anche altre persone: dopo una prima condanna al manicomio criminale, terminò i suoi giorni in carcere, ucciso da un compagno di cella.
Oltre a Graham Young, un'altra serie di avvelenamenti col tallio fu realizzata da Martha Marek, la quale spedì all'altro mondo il marito, un parente, una sua pensionante e la di lei figlia di soli nove mesi. Il 6 dicembre 1938 la Marek fu ghigliottinata per i suoi orrendi crimini: Hitler, che da poco aveva annesso l'Austria al Reich, aveva appena reintrodotto la pena capitale.
Il tallio (Tl), elemento del gruppo del boro, ha Z=81. Fu scoperto da Crookes nei fanghi residui delle camere di piombo e deve al suo nome al colore verde germoglio (= thallos, in greco) di una riga caratteristica osservata sullo spettro.
Forma prevalentemente composti monovalenti: lo ione Tl+ è, negli organismi viventi, vicariante del catione potassio (e per questo esplica la sua azione tossica). Presenta molte caratteristiche simili a quelle dei metalli alcalini: si ossida facilmente all'aria, in acqua forma idrossido talloso, TlOH.
La sua chimica si spiega con la perdita dell'unico elettrone alloggiato in un orbitale p, mentre con più difficoltà perde i due elettroni negli orbitali s per dare il catione trivalente: dal 1927 fu introdotta da Sidgwick l'espressione "coppia inerte" per indicare questo fenomeno (e non tanto la sua spiegazione), dovuto agli orbitali d, agli orbitali f (contrazione lantanidica) e a effetti relativistici. [1] Altri autori chiamano in causa spiegazioni più complesse, giustificate sempre con effetti relativistici.
[1] A. F. Holleman; E. Wiberg, Inorganic Chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
giovedì 7 dicembre 2017
Il "genetliaco" di una passione...
Per i bambini delle zone dove risiedo, il giorno di San Niccolò (6 dicembre, memoria liturgica di San Nicola, vescovo di Mira) è tanto atteso quanto speciale.
Il vescovo, con la lunga barba bianca, accompagnato dal suo asinello, si annuncia al suono di una campanella: i bambini vanno a letto e, al risveglio, trovano in cucina (o in salotto) qualche pacco dono da scartare. O magari del carbone (dolce...!) se sono stati birichini...
Il 6 dicembre 1987, esattamente 30 anni fa, ho trovato sul tavolo della cucina questa cosa qui (beh... l'immagine è presa dal web, di quello mio resta ben poco):
Mi chiedo se il mio interesse per la chimica e per le scienze naturali sia nato qui (vorrei rispondere con un convinto "si", ma devo concedermi il beneficio del dubbio), anche se poi si è spento negli anni delle superiori (meglio che non scriva il perché).
Il mio interesse per questa materia si è risvegliato anni dopo e in un contesto che ancor oggi mi sorprende, quando ci ripenso: al termine di un seminario di cinque lezioni sulle meridiane, tenuto da un sacerdote che per una vita ha insegnato scienze naturali in un liceo paritario della mia città, mentre attendevo agli studi di filosofia e di teologia (che ho concluso da laico, anche se per qualche mente eletta comunque "puzzo troppo da prete per fare carriera accademica"...).
Avendo la disponibilità economica e mosso da forti motivazioni, ho deciso di tentare di studiare la chimica in modo più rigoroso e il resto è storia (più o meno) nota.
Oggi insegno felicemente questa materia in una scuola paritaria e sono felice di poter condividere questa mia passione con gli studenti. Spero che il tentativo sia apprezzato anche da loro.
domenica 3 dicembre 2017
CLAIR DE LUNE...
Ammirando dalla finestra il sorgere della luna, ieri sera, mi sembrava di ascoltare Debussy mentre componeva il celeberrimo terzo movimento della Suite bergamasca...
venerdì 1 dicembre 2017
POSTILLE A UNA CONFERENZA
Al termine dell'ultima mia conferenza di quest'anno, tenuta il 30 novembre a Pieve d'Alpago, ospite della sezione locale dell'Auser, ho avuto il piacere di conoscere un signore che ha lavorato in Svizzera, per ben trentasei anni, nel settore carpenterie metalliche di un'importante industria chimica, la Lonza. Con il signore di cui sopra e altre persone ho continuato la conversazione al Bar Centrale, dove - tra le tante cose - si degusta un ottimo gelato artigianale.
Lonza, fornitore leader di prodotti per la farmaceutica, per la sanitaria e per le scienze della vita, ha celebrato quest'anno i 120 anni dalla fondazione. L'azienda nacque nel 1897 a Gampel, nel Canton Vallese, sulle rive del fiume omonimo.
Inizialmente l'azienda produceva elettricità in una piccola centrale idroelettrica, usata per fabbricare carburo di calcio: la miscela di calcare e carbone reagiva in un forno ad arco elettrico, capace di raggiungere le elevate temperature (oltre i 2000°C) necessarie alla sintesi. Il carburo usciva dal forno allo stato fuso, si raffreddava e solidificava.
Inizialmente l'azienda produceva elettricità in una piccola centrale idroelettrica, usata per fabbricare carburo di calcio: la miscela di calcare e carbone reagiva in un forno ad arco elettrico, capace di raggiungere le elevate temperature (oltre i 2000°C) necessarie alla sintesi. Il carburo usciva dal forno allo stato fuso, si raffreddava e solidificava.
Qualche anno dopo, Lonza si stabilì a Visp, dove si espanse e da azienda produttrice di elettricità divenne leader nel settore chimico: nel 1909 cominciò la produzione di concimi azotati (ammoniaca), nel 1920 quella di acido nitrico e di altri derivati dell'acetilene (acetaldeide, acido acetico, cloruro di vinile, etc.).
L'acetilene fu per qualche decennio un intermedio importante, non solo alla Lonza ma in molti altri stabilimenti chimici: oggi conosce una nuova attualità, come racconta QUI il professor Giorgio Nebbia.
Per produrlo bastavano calcare e carbone da cui si otteneva il carburo di calcio, come sopra ricordato: calcare e carbone (di legna) abbondano come risorse naturali in montagna, assieme all'acqua dolce e questo potrebbe aver favorito la nascita dell'industria chimica in montagna, almeno in un primo tempo.
Come scoprì Wohler mezzo secolo prima, carburo di calcio e acqua reagiscono per formare acetilene e un residuo inutilizzabile (almeno allora: ora si usa come base per fabbricare cemento). La stessa reazione era sfruttata nelle lampade da minatore e oggi nelle lampade da speleologo.
Dall'acetilene, mediante reazioni catalizzate da sali di mercurio, di rame o di zinco, si ottenevano prodotti necessari alla sintesi dei monomeri vinilici, usati per produrre le prime materie plastiche (PVC, poliacetati) e le fibre tessili sintetiche (acriliche).
L'acetilene fu per qualche decennio un intermedio importante, non solo alla Lonza ma in molti altri stabilimenti chimici: oggi conosce una nuova attualità, come racconta QUI il professor Giorgio Nebbia.
Per produrlo bastavano calcare e carbone da cui si otteneva il carburo di calcio, come sopra ricordato: calcare e carbone (di legna) abbondano come risorse naturali in montagna, assieme all'acqua dolce e questo potrebbe aver favorito la nascita dell'industria chimica in montagna, almeno in un primo tempo.
Come scoprì Wohler mezzo secolo prima, carburo di calcio e acqua reagiscono per formare acetilene e un residuo inutilizzabile (almeno allora: ora si usa come base per fabbricare cemento). La stessa reazione era sfruttata nelle lampade da minatore e oggi nelle lampade da speleologo.
Dall'acetilene, mediante reazioni catalizzate da sali di mercurio, di rame o di zinco, si ottenevano prodotti necessari alla sintesi dei monomeri vinilici, usati per produrre le prime materie plastiche (PVC, poliacetati) e le fibre tessili sintetiche (acriliche).
Dal 1965, l'acetilene fu sostituito con la nafta di petrolio (uno scarto di raffineria impiegato, previa desolforazione, come solvente e come carica per cracking) in qualità di materiale di partenza per il settore organico. Da essa, l'azienda produce tuttora intermedi per l'industria farmaceutica e agrofarmaceutica, per il settore alimentare, per l'industria degli adesivi, etc.
Il signore mi raccontava della sua esperienza nel lavorare i metalli, acquisita sul campo, dentro la fabbrica: nella città natale aveva imparato un po' il mestiere, ma si trattava di lavorare comune lamiera. Nello stabilimento svizzero si è trovato a dover lavorare il tantalio, lo zirconio, l'hastelloy (una lega a base di nichel resistente alla corrosione e usata per fare impianti).
Raccontava del reparto dove, da mercurio metallico, si produceva un tempo l'ossido di mercurio da introdurre nel reattore per la sintesi dell'acetaldeide. Schematizzando:
Raccontava del reparto dove, da mercurio metallico, si produceva un tempo l'ossido di mercurio da introdurre nel reattore per la sintesi dell'acetaldeide. Schematizzando:
- l'ossido di mercurio, nel reattore, reagisce con l'acido solforico in soluzione acquosa diluita per dare solfato di mercurio;
- il solfato mercurico catalizza l'idratazione dell'acetilene ad acetaldeide;
- in uno stadio successivo, l'acetaldeide è poi ossidata per dare acido acetico.
Ho ascoltato con piacere questi frammenti, contrappuntati da qualche digressione sulla vita operaia e di emigrante. Chissà che l'acetilene e le sue antiche (e future, a quanto pare) lavorazioni non possano diventare l'argomento di un prossimo incontro.
venerdì 24 novembre 2017
SCHEMINI SUL LEGAME CHIMICO
Pubblico in questo post qualche schema dedicato al legame chimico: alcuni sono presi dal web, altri sono stati elaborati da me. Cominciamo con un'introduzione a carattere generale:
Riprendiamo brevemente la formazione di un legame ionico, che consiste nell'attrazione elettrostatica tra ioni di carica opposta: cationi (+) e anioni (-).
L'atomo di un elemento (a bassa energia di ionizzazione) può perdere uno o più elettroni per formare il catione (ione positivo) corrispondente (es. Na dà Na+), isoelettronico del gas nobile che lo precede nella tavola periodica; gli elettroni persi sono acquistati dall'atomo di un elemento (con un elevato valore assoluto di affinità elettronica) che dà un anione (ione negativo: es. Cl dà Cl-), isoelettronico del gas nobile che lo segue nella tavola periodica.
Na+ e Cl- si attraggono per formare il composto ionico NaCl.
Diverso è il caso del legame covalente, dove una coppia di elettroni è condivisa tra due atomi sempre allo scopo di completare il livello energetico più esterno e renderlo isoelettronico a quello del gas nobile più vicino.
Se i due atomi sono uguali (legame omopolare), la coppia di elettroni sarà equidistante dai due nuclei; se i due atomi sono diversi (legame eteropolare), la coppia di elettroni sarà spostata verso l'atomo più elettronegativo.
L'elettronegatività è la capacità di un elemento di attirare a sé gli elettroni di legame: l'elemento più elettronegativo è il fluoro, quelli meno elettronegativi si trovano invece a sinistra, tra i metalli alcalini.
La differenza di elettronegatività tra due atomi impegnati in un legame permette di distinguere un legame covalente puro, un legame polare e un legame ionico.
Il tipo di legami in gioco si riflette nelle proprietà macroscopiche della materia: consideriamo ad esempio solidi molecolari, solidi ionici e solidi metallici, confrontati nello schema sottostante.
Per concludere, ecco un breve riassunto di tutto quanto sopra accennato, da me riportato in una parte di una scheda nella quale approfondivo originariamente anche le teorie più complesse sulla natura del legame chimico che per ragioni di brevità quest'anno ometterò (o meglio: forse richiamerò più avanti).
Grazie per la lettura! MC
martedì 14 novembre 2017
La Tavola Periodica in breve...
Ho tentato di abbozzare un riassunto ad uso didattico di alcune idee sulla Tavola Periodica nella versione moderna, dividendo la descrizione di ciascun blocco e delle caratteristiche principali degli elementi che vi fanno parte. Qua e là ho regalato anche alcune sottolineature sugli elementi più importanti (del primo, del secondo e del quarto gruppo "A").
PS: i video non sono miei, ma linkati da youtube.
sabato 11 novembre 2017
BOHR
Niels Henrik David Bohr nasce a Copenaghen il 7 ottobre 1885 e compie gli studi presso l'università della sua città natale, dove il padre gestisce la cattedra di fisiologia (e dove in seguito il fratello Harald diventerà ordinario di Matematica). Si laurea nel 1909, quindi completa il dottorato con una tesi sulle teorie del passaggio delle particelle attraverso la materia.
Nello stesso anno si reca presso l'università di Cambridge per studiare fisica nucleare nel famoso Cavendish Laboratory, diretto da Thompson, ma a causa di forti divergenze con quest'ultimo, passa a Manchester dove inizia a lavorare con Rutherford, concentrandosi principalmente sull'attività degli elementi radioattivi.
Nel 1913 presenta la prima bozza del "suo" modello atomico, che si basa sulle scoperte di Max Planck per ciò che riguarda il "quanto d'azione", offrendo un contributo decisivo allo sviluppo della meccanica quantistica, il tutto spinto anche dalla scoperta del suo "mentore" Rutherford, il nucleo atomico.
Nel 1916 Bohr viene chiamato all'università di Copenaghen come professore di fisica, e nel 1921 diviene direttore dell'Istituto di Fisica Teorica (del quale rimarrà a capo fino alla sua morte), compiendo importanti studi sui fondamenti della meccanica quantistica, studiando la composizione dei nuclei, la loro aggregazione e la disintegrazione, riuscendo così a giustificare anche i processi di transizione.
Nel 1913 presenta la prima bozza del "suo" modello atomico, che si basa sulle scoperte di Max Planck per ciò che riguarda il "quanto d'azione", offrendo un contributo decisivo allo sviluppo della meccanica quantistica, il tutto spinto anche dalla scoperta del suo "mentore" Rutherford, il nucleo atomico.
Nel 1916 Bohr viene chiamato all'università di Copenaghen come professore di fisica, e nel 1921 diviene direttore dell'Istituto di Fisica Teorica (del quale rimarrà a capo fino alla sua morte), compiendo importanti studi sui fondamenti della meccanica quantistica, studiando la composizione dei nuclei, la loro aggregazione e la disintegrazione, riuscendo così a giustificare anche i processi di transizione.
 |
| Dal web, un aneddoto che sa di leggenda... |
Quando nel 1939 la Danimarca viene occupata dai nazisti, si rifugia in Svezia per evitare l'arresto dal parte della polizia tedesca (era ebreo per parte di madre), passando quindi in Inghilterra, per stabilirsi infine negli Stati Uniti, ove risiede per circa due anni, seguendo lo stesso iter di scienziati quali Fermi, Einstein ed altri. Qui collabora al Progetto Manhattan, finalizzato alla realizzazione della bomba atomica, fino all'esplosione del primo esemplare, nel 1945.
Terminata la guerra, Bohr torna a insegnare all'università di Copenaghen, dove si impegna per promuovere lo sfruttamento pacifico dell'energia atomica e la riduzione dell'uso di armi con potenziale atomico. È tra i fondatori del CERN, oltre ad essere il presidente della Reale accademia delle scienze danese.
Alla sua morte, avvenuta il 18 novembre 1962, il corpo viene sepolto nella Assistens Kirkegaard, nella zona di Norrebro, a Copenhagen.
A suo nome è presente un elemento della tabella chimica di Mendeleev, il Bohrium, presente tra gli elementi transuranici con il numero atomico 107.
A suo nome è presente un elemento della tabella chimica di Mendeleev, il Bohrium, presente tra gli elementi transuranici con il numero atomico 107.
martedì 7 novembre 2017
Radio, Polonio e la fisica del XX secolo.
Nel 1896, il fisico francese Henry
Becquerel (1852-1908), studiando la fosforescenza dei sali di uranio, scoprì
accidentalmente la radioattività naturale, un fenomeno per il quale un elemento
emette spontaneamente radiazione, senza preventiva eccitazione.
Una sostanza
fosforescente, esposta alla luce (o alla radiazione ultravioletta), emette
radiazione per un certo periodo; l’emissione continua anche quando è cessata
l’esposizione alla luce.
Un esempio di sostanza fosforescente è il solfuro di
bario, ottenuto riducendo il solfato di bario (barite) con carbone: per questa
sua proprietà il solfuro di bario era noto agli alchimisti come fosforo di
Bologna – così chiamato perché scoperto agli inizi del XVII secolo da un
ciabattino di Bologna, Vincenzo Casciarolo, dilettante di alchimia.
Se l’effetto è
immediato e cessa con l’eccitazione si parla invece di fluorescenza. Un esempio
di sostanza fluorescente è dato dalla fluorite (fluoruro di calcio), cui deve
nome il fenomeno.
I sali di uranio
studiati da Becquerel invece erano, ad esempio, in grado di impressionare una
lastra fotografica (e quindi di emettere una radiazione, pur non visibile –
cioè non percepibile con la vista) anche senza essere prima esposti alla luce.
Del fenomeno s’interessò Marie Sklodowska (1867-1934), moglie del fisico Pierre
Curie (1859 -1906) e studentessa che cercava un argomento per la sua tesi di
dottorato.
Marie cominciò a
studiare un minerale dell’uranio, la pechblenda, proveniente dalle miniere di
Joachimstahl in Boemia, rilevando che alcuni campioni di esso manifestavano il
fenomeno dell’emissione spontanea in modo più intenso di altri: erano cioè più
radioattivi di quanto lo sarebbero stati se costituiti di uranio puro e ciò
implicava che nella pechblenda fossero presenti elementi in quantità minime non
rilevate dalla normale analisi chimica, la cui radioattività fosse molto alta.
Nel 1898, dopo
aver raffinato quattro tonnellate di pechblenda, Marie e Pierre ottennero pochi
decigrammi di due nuovi elementi, il polonio e il radio - sottoforma di cloruro
(RaCl2) e di bromuro (RaBr2).
Soltanto nel
1902 il radio fu isolato puro, nella sua forma metallica bianca lucente, dalla
stessa Marie Curie e da André Louis Debierne (1874-1949): ciò valse a Marie
Curie (e a Debierne) il premio Nobel per la chimica nel 1911.
Il radio trovò
ben presto impiego in medicina; fu inoltre utilizzato per produrre vernici
luminescenti da usare sulle lancette degli orologi subacquei (come il Radiomir, della Regia Marina Italiana) e
degli altimetri degli aeroplani militari, sottoforma di solfato mescolato a
carbonato di bario e solfuro di zinco in una matrice di olio di semi di lino.
Durante gli anni
Trenta si scoprì che i lavoratori esposti al radio nelle fabbriche che usavano
vernice luminescente si ammalavano gravemente, per lo più di anemia e cancro
alle ossa: in seguito a queste evidenze cliniche l'impiego del radio declinò
rapidamente.
Il radio è
trattato dall'organismo alla stregua del calcio e depositato nel tessuto osseo,
dove la radioattività provoca gravi danni, inducendo il cancro e la leucemia.
L'aver maneggiato il radio per anni è ritenuta la causa della lunga malattia
che ha portato Marie Curie alla morte.
Sulla via
tracciata dai coniugi Curie proseguirono altri scienziati, come il neozelandese
Ernst Rutherford (1871-1937), trasferitosi in Gran Bretagna. Egli indagò la
natura della radiazione emessa spontaneamente dai minerali radioattivi e scoprì
che consisteva in tre tipi di raggi, chiamati alfa (nuclei di elio, 4He),
beta (elettroni) e gamma (radiazioni ad altissima energia).
Utilizzando i
raggi alfa come proiettili per bombardare una sottilissima lamina d’oro, si
accorse che la maggior parte di essi passava indenne, mentre altri erano
respinti indietro, come se “una palla di cannone rimbalzasse contro un foglio
di carta velina”. Da queste osservazioni sperimentali Rutherford dedusse che
tutta la massa di un atomo dovesse essere concentrata al suo centro, in un
nucleo carico positivamente che respingeva indietro i raggi alfa (anch’essi con
carica positiva) che gli sbattevano contro. Attorno al nucleo, come pianeti
attorno al sole, ruotavano gli elettroni, scoperti da John Joseph Thompson nel
1897 studiando la scarica elettrica nei gas rarefatti attraverso l’impiego di
tubi a raggi catodici.
Nel 1919
Rutherford bombardò l’azoto purissimo con particelle alfa. Analizzando il gas dopo il trattamento
osservò che si era formato ossigeno:
4He + 14N
→ 17O + 1H
Si trattava
della prima trasmutazione (di un elemento in un altro) compiuta da uomo nella
storia dell’umanità: un evento che aprì le porte alla fisica nucleare, la
fisica del XX Secolo.
mercoledì 1 novembre 2017
Un brevissimo sguardo generale sulle fibre ...
Recentemente, parlando degli innumerevoli usi della cellulosa, ho avuto modo di offrire una digressione culturale sulle fibre tessili e in particolare sul loro uso per confezionare capi destinati agli sportivi.
Riporto uno schema, preso dal web, che riporta una buona sintesi dei contenuti da me proposti (clikkate per ingrandire) e ampliati a lezione con caratteristiche e impieghi delle varie fibre.
Riporto uno schema, preso dal web, che riporta una buona sintesi dei contenuti da me proposti (clikkate per ingrandire) e ampliati a lezione con caratteristiche e impieghi delle varie fibre.
Ho completato la presentazione proponendo qualche filmato da youtube e un'osservazione al microscopio di alcune di esse (lana, seta, nylon, etc.).
Il video sotto mostra la preparazione su piccola scala del Rayon Bemberg, ottenuto sciogliendo la cellulosa nel cuprammonio e riprecipitandola in un bagno acido.
Il secondo video, un cortometraggio dal titolo "Sette canne, un vestito" mostra invece la lavorazione del rayon su scala industriale, con il processo allo xantato, e porta la regia di Michelangelo Antonioni - che lo ha girato in buona parte nei capannoni di Torviscosa.
domenica 29 ottobre 2017
Il tramonto di stasera ...
Mentre ho ammirato, in internet, le foto del tramonto di stasera, 29 ottobre 2017, nell'Italia Nord-Occidentale (da Milano verso Torino), mi sono accontentato di scattare questo (clikkate per ingrandire).
Di certo non regge il confronto con quei cieli ammirati in quel di Milano - che sembrano dipinti da Van Gogh o forse da Munch...
domenica 22 ottobre 2017
Un allievo di Gay-Lussac...
Hector Berlioz (1803-1869), il musicista francese passato alla storia per un celebre trattato di orchestrazione e per la composizione di una serie di partiture con organici vocali e orchestrali imponenti (il suo "Te Deum" richiede diverse centinaia di esecutori e così il "Requiem", con le quattro orchestre di ottoni che annunciano il giudizio finale nel "Tuba mirum"), fu costretto in gioventù a tentare gli studi di medicina a Parigi.
I genitori gli spedivano un cospicuo assegno mensile che il nostro spendeva in opere e concerti, anziché per frequentare l'università.
In realtà, nei suoi diari ricordava di detestare gli studi di anatomia e di clinica, mentre provava un certo fascino per le lezioni di Thenard (chimica), di Biot e di Gay-Lussac (fisica).
Anche questi sono "episodi della vita di un'artista" - come quelli evocati nella sua Sinfonia Fantastica op. 14, dove il giovane autore si racconta innamorato, non corrisposto e, avendo esagerato con una dose di oppio, "fantastica" - appunto - di vedere l'amata prima ad un ballo, poi tra le Alpi svizzere (si odono in lontananza i suoni che ricordano i ranz des vachez), quindi al suo stesso supplizio sulla ghigliottina e infine al funerale - con le campane a morto, il Dies Irae gregoriano e il sabba delle streghe compiaciute della sua morte, tra cui compare nuovamente l'amata.
giovedì 19 ottobre 2017
ELIO E GEO IN UN GRAFICO CONFRONTO
Questa splendida GIF mette a confronto due concezioni del cosmo differenti: la teoria eliocentrica descritta da Copernico (a sinistra) e la teoria geocentrica di Tolomeo (a destra).
La teoria eliocentrica, per altro già intuita da Aristarco di Samo (310-230 a.C.) e riproposta da Niccolò Copernico nel XVI secolo, considera il sole al centro del sistema solare (intuizione corretta), attorno al quale ruotano i pianeti in orbite circolari (errore!).
Solo successivamente Keplero sostituirà le orbite circolari con le orbite ellittiche, di cui il sole occupa uno dei due fuochi. Pertanto, ciascun pianeta non è equidistante dal sole in ogni punto della sua orbita e la sua velocità di rivoluzione varia e risulta massima in perielio (punto di massima vicinanza al sole) e minima in afelio (massima distanza dal sole). Ciò sarà spiegato poi da Newton, che sostituì agli spiritelli di Keplero la più scientifica forza di gravità.
La teoria eliocentrica ha sostituito la teoria geocentrica ipotizzata da Tolomeo e descritta da lui nell'Almagesto: la terra è al centro del cosmo e attorno ad essa ruotano gli oggetti celesti compiendo un moto assai complesso, ben rappresentato nella figura.
La teoria di Tolomeo, pur nei suoi limiti, ebbe una grande influenza sulla cultura e sugli autori successivi, da Dionigi l'Aeropagita a Dante Alighieri.
Leggendo la Divina Commedia emerge infatti una descrizione del cosmo in piena sintonia con la concezione geocentrica: la terra, sferica, al centro, nel cui ventre si apre l'inferno, e attorno i cieli traboccanti dell'Amor che move il sole e le altre stelle.
... buono studio!
venerdì 13 ottobre 2017
Il cielo in rassegna...
Presento in questo breve post una rassegna di immagini interessanti riguardanti il cielo. Alcune sono amatoriali, altre circolano in internet. Dedico la rassegna ai miei discenti e inizio con un classico: la Via Lattea, ripresa da un amico (Mattia Giacomello) e da me rielaborata in una post-produzione.
Proseguo con il diagramma H/R, che classifica le stelle in base alla magnitudo (da nane a giganti) e alla temperatura esterna, cui corrispondono i colori dal rosso al blu. Quasi tutte le stelle descrivono una sequenza principale che attraversano il diagramma in diagonale, da sinistra in alto a destra in basso.
Il diagramma permette di prevedere il destino di una stella, riassunto dallo schema seguente (clikkate per ingrandire).
Una foto affascinante mostra la costellazione di Orione, presa in Norvegia (dal web), con poco inquinamento luminoso: in alto, Betelgeuse (a sx, rossa), Bellatrix (a dx); le tre stelle della cintura e in basso Rigel (a sx, molto luminosa); tra le "gambe" si intravede la nebulosa brillare di luce gialla.
Per sentirci piccoli nell'universo, osserviamo la seguente sequenza che paragona la Terra agli altri pianeti interni; poi i pianeti interni ai pianeti esterni; poi i pianeti al sole; quindi il sole alle altre stelle di dimensioni crescenti:
Limitandoci alla famiglia del Sole, ecco un'immagine d'insieme:
Infine, ecco il mio unico scatto, in cui immortalo il "bacio" che Giove e Venere (i due puntini luminosi al centro della foto) si sono scambiati qualche anno fa nei nostri cieli:
martedì 10 ottobre 2017
Dirac: un libro per una vita "segreta".
Paul Dirac (1902-1984), detto "il taciturno", era una figura dalle mille contraddizioni, che dovevano fare di lui l'uomo più strano del secolo: impacciato nella conversazione e mirabile nell'esposizione scientifica, timido con le donne e insieme capace di lasciarsi attrarre dal fascino femminile, rigoroso con colleghi e studenti e intanto appassionato di Topolino, freddo "come un ghiacciolo", ma anche pronto a battersi fino all'ultimo in difesa dei propri amici.
Questo era "il fisico più bizzarro del mondo", colui che ha ricostruito l'intero edificio della meccanica quantistica, ha "inventato" l'antimateria prima di qualsiasi conferma sperimentale, ha ripensato insieme la fisica del molto grande e del molto piccolo aprendo nuovi orizzonti nella comprensione dell'Universo. E tutto ciò, come lui stesso amava ripetere, "lasciandomi prendere per mano dalla matematica".
Questo era "il fisico più bizzarro del mondo", colui che ha ricostruito l'intero edificio della meccanica quantistica, ha "inventato" l'antimateria prima di qualsiasi conferma sperimentale, ha ripensato insieme la fisica del molto grande e del molto piccolo aprendo nuovi orizzonti nella comprensione dell'Universo. E tutto ciò, come lui stesso amava ripetere, "lasciandomi prendere per mano dalla matematica".