Un paio di post fa, QUI, parlando di addizione elettrofila al doppio legame C=C, ho evidenziato più volte come si formi un intermedio detto carbocatione:
R-CH=CH2 + H+ -> R-CH+-CH3
Cosa fa un carbocatione? - chiedeva il professore di Chimica Organica a lezione (e all'esame). La risposta è: Traspone, elimina, addiziona.
Un carbocatione
può trasporre ad un carbocatione più stabile: la carica positiva "sta meglio" su
un atomo di carbonio legato ad almeno altri due (carbocatione secondario) o tre
atomi di carbonio (carbocatione terziario) piuttosto che su uno legato a un
solo atomo di carbonio (carbocatione primario).
Ancora, un
carbocatione può eliminare un atomo di idrogeno per formare un doppio legame: si forma prevalentemente il doppio legame C=C più sostituito (Regola di Zaitzev). Prendiamo ad
esempio l’etanolo, C2H5OH, riscaldato con un po’ di acido solforico in un
pallone.
C2H5OH + H+ -> C2H5+ + H2O
L’H+ donato
dall’acido attacca il gruppo -OH dell’alcol; se lo porta via e si forma il
carbocatione C2H5+. Questo carbocatione può eliminare un idrogeno e formare
etilene, C2H4.
C2H5+ -> C2H4 + H+
Ma un
carbocatione può infine addizionare un nucleofilo per formare un nuovo
composto. Così il carbocatione C2H5+ può addizionare il nucleofilo acqua per
dare di nuovo etanolo e H+, oppure può addizionare una molecola di etanolo
(altro nucleofilo per via dei doppietti elettronici liberi sull’ossigeno) per
dare etere dietilico, C2H5-O-C2H5 e H+.
IMPORTANZA INDUSTRIALE DEI CARBOCATIONI
La chimica dei carbocationi
è molto sfruttata a livello industriale: i processi di cracking catalitico, di
isomerizzazione e di alchilazione si basano su di essa. Opportuni catalizzatori
a base di acidi di Lewis, come AlCl3, silice e allumina, che favoriscono la
formazione di carbocationi vengono largamente utilizzati nei primi due
processi; nel terzo si impiegano acido solforico o acido fluoridrico.
In particolare
nell’isomerizzazione si sfrutta il fatto che un carbocatione traspone per
ottenere molecole ramificate. Così un idrocarburo
lineare a cinque o sei atomi di carbonio, riscaldato in presenza del
catalizzatore fino a 100°C, ramifica; un idrocarburo lineare a quattro atomi di
carbonio invece riarrangia a isobutano: se prima i quattro atomi di carbonio
erano uno dietro l’altro, ora tre atomi di carbonio stanno, per così dire, in
fila mentre il quarto si attacca di lato al secondo.
L’isobutano,
separato dagli idrocarburi a cinque o sei atomi di carbonio e dalle frazioni
più leggere, viene inviato all’alchilazione: il carbocatione terziario che da
esso deriva addiziona questa volta nucleofili come le olefine terminali (con il
doppio legame sul carbonio più esterno) presenti nei prodotti di cracking per
formare quegli idrocarburi saturi ramificati (con tutti legami semplici) che
costituiscono la benzina sintetica.
Il processo di
alchilazione si realizza in lunghi reattori orizzontali ove olefine, isobutano
e acido fluoridrico vengono tenuti a temperature tra 20 e 40°C e a pressioni di
7-18 atmosfere.
POTERE ANTIDETONANTE DI UNA BENZINA
Perché gli
idrocarburi che costituiscono la benzina devono essere ramificati? Perché gli
idrocarburi ramificati conferiscono alle benzine una migliore qualità in
termini di numero di (iso)ottano, che misura il potere antidetonante.
La benzina ricca di idrocarburi ramificati (ad alto numero di ottano) non detona in anticipo nella camera di scoppio di un motore, come accade con quella formata da idrocarburi lineari, ma solamente quando il pistone raggiunge il punto morto superiore e scocca la scintilla di accensione.
La benzina ricca di idrocarburi ramificati (ad alto numero di ottano) non detona in anticipo nella camera di scoppio di un motore, come accade con quella formata da idrocarburi lineari, ma solamente quando il pistone raggiunge il punto morto superiore e scocca la scintilla di accensione.
Altri accorgimenti
per aumentare il potere antidetonante di una benzina sono l’incremento della
percentuale di aromatici e di composti ossigenati (come
il metil-terzbutil-etere, MTBE). All’uopo un tempo si aggiungeva il famigerato
piombo-tetraetile, oggi messo al bando vista la sua tossicità.
La benzina è
forse il più importante tra i carburanti ricavati dal petrolio; è costituita
dalla frazione C5-C12 di idrocarburi saturi (paraffine), che bolle tra i 35 e i
200 °C.
La benzina di
prima distillazione è però inutilizzabile nei motori a scoppio e quindi deve
subire successive lavorazioni per essere migliorata in qualità. Quattro sono i
processi industriali dai quali si ricava la benzina che finisce nel serbatoio
delle nostre automobili:
- il cracking catalitico;
- il reforming catalitico;
- l’isomerizzazione delle frazioni C5-C6;
- l’isomerizzazione delle frazioni C4 a isobutano e la successiva alchilazione di olefine al fine di ottenere paraffine ramificate.
Il catalizzatore acido è una particolare resina solfonata; per favorire la formazione del prodotto, questo è allontanato continuamente per distillazione e poi purificato da eventuali tracce di C4 non reagiti. Anche il metanolo in eccesso è separato e riciclato.
La slide in inglese racconta come questo etere sia un'invenzione tutta italiana - che piace poco negli USA, ove è ritenuto un pericoloso agente inquinante ed è sostituito da altri additivi.
STABILIZZAZIONE DI UNA BENZINA
Da qualsiasi processo provenga, la benzina necessita di essere stabilizzata. La
stabilizzazione di una benzina è un'operazione che si effettua su benzine di
prima distillazione (topping) o anche su benzine di reforming o di
alchilazione, e questo perché nelle benzine "primarie" oltre alla frazione
C5-C12 sono contenuti idrocarburi volatili C1-C3 che vanno eliminati.
Una
caratteristica molto importante delle benzine infatti è la tensione di vapore,
misurata in un recipiente chiuso a T = 100 °F (37,8 °C) e che non deve superare
0,65 bar (0,8 bar in inverno, necessari per facilitare la partenza a freddo):
viene così limitata la volatilità dei carburanti, pericolosa se troppo elevata,
perché potrebbe provocare sia fughe di vapori infiammabili, sia vapor-lock
(tappo di vapore), dovuto a un'eccessiva vaporizzazione della benzina nel
canale di arrivo al carburatore, che causa l'arresto del motore.
La causa di
un’eccessiva tensione di vapore di una benzina è dovuta appunto alla presenza
di prodotti leggeri che vanno eliminati e a questo serve la stabilizzazione: a
eliminare gas incondensabili e GPL.
La benzina
primaria (ad alta tensione di vapore) viene immessa in una colonna a piatti, a
circa metà colonna.
In fondo alla
colonna si ha un ribollitore (riscaldato con vapore acqueo attraverso uno scambiatore
di calore).
Dal fondo della
colonna viene prelevata la benzina stabilizzata, in parte reimmessa nella zona
di ribollizione
La colonna
lavora sotto pressione per poter impiegare acqua come liquido refrigerante in
modo tale da aver condensazione dei C3 e dei C4 a queste temperature (circa
35-40°C).
I gas vengono
prelevati dalla testa della colonna, raffreddati con acqua in un condensatore e
separati in gas incondensabili e GPL.
Parte del GPL
viene reimmesso per riflusso in cima alla colonna: ed è sempre sfruttando i
delicati equilibri liquido-vapore che è possibile arricchire la frazione più
pesante di frazioni C5-C12 a discapito delle frazioni più leggere che vengono
allontanate in testa alla colonna.
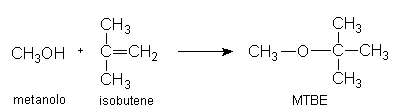

Nessun commento:
Posta un commento