Nel post precedente accennavo alla reazione di sostituzione radicàlica, per mezzo della quale si preparano i derivati clorurati del metano. Più genericamente, per reazione
degli idrocarburi saturi con il cloro ad alta temperatura si ha sostituzione di
uno o più atomi di idrogeno con atomi di cloro e contemporanea formazione di
acido cloridrico:
R-H + Cl2
->
R-Cl + HCl
Dalla reazione
del metano con il cloro si ricavano contemporaneamente:
- cloruro di metile (clorometano);
- cloruro di metilene (o diclorometano);
- cloroformio (o triclorometano);
- tetracloruro di carbonio (o tetraclorometano).
Da questi
composti si ottengono poi altri derivati importanti, impiegati come solventi
(es. nel lavaggio a secco, come la trielina
e il percloroetilene), come
refrigeranti nei frigoriferi, come anestetici, come ritardanti di fiamma, come
propellenti nelle bombolette spray (CFC, clorofluorocarburi) o come materie di
partenza per la sintesi di importanti materie plastiche, quali il teflon (derivato dal perfluoroetilene), usato nelle padelle
antiaderenti, o il goretex.
L’uso di questi
composti è severamente regolamentato, in quanto la loro dispersione
nell’ambiente è connessa al fenomeno noto come “buco nell’ozono”.
DA ALCOLI. Altri modi per ottenere questi e composti simili erano noti già ai chimici del XIX secolo, che facevano bollire per un tempo
prolungato un alcol con l'acido cloridrico (o con una mistura di sale e acido
solforico) e avevano i cloruri alchilici corrispondenti.
R-OH + HCl -> R-Cl + H2O
Per ottenere i bromuri, usavano
bromuro di potassio e acido solforico; gli ioduri li ottenevano per
transalogenazione, facendo reagire cioé un bromuro o un cloruro alchilico con
ioduro di sodio o di potassio in ambiente neutro (in ambiente acido si
formerebbe HI che fungerebbe da riducente).
Successivamente ebbero a
disposizione gli alogenuri di fosforo - reagenti molto aggressivi, che permisero
a Ugo Schiff di scoprire il cloruro di tionile, SOCl2.
Georges Darzens, chimico
francese, impiegò il cloruro di tionile definendo un metodo generale per sostituire un gruppo alcolico -OH con un
atomo di cloro Cl:
"Questa procedura usa cloruro di tionile in presenza di una base
terziaria [ammina]. Si è mostrata essere di valenza universale, permettendo
tale sostituzione anche in molecole fragili, come terpeni, alcoli e steroli".
Questa reazione l'avevo studiata
al primo anno, durante le lezioni di reattività organica fondamentale,
impartite dal prof. De Lucchi. I miei compagni se la ricorderanno:
R-OH + SOCl2 -> R-Cl + SO2 + HCl
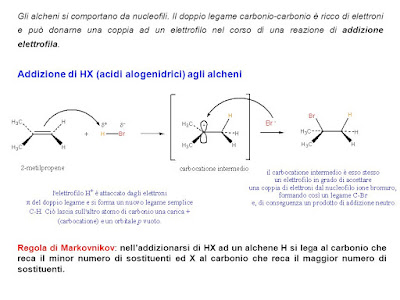
DA ALCHENI. E' possibile ottenere un alogenùro alchilico per addizione elettrofila di un acido alogenidrico (cloridrico, bromidrico) a un alchene.
L'addizione di HBr a un doppio legame C=C può avvenire secondo due vie: meccanismo ionico (quello descritto sopra) oppure meccanismo radicalico (o allilico). Consideriamo la reazione con il propene:
Il meccanismo ionico porta alla formazione del 2-bromo-propano, mentre il meccanismo radicalico porta alla formazione dell'1-bromopropano.
Per addizione di cloro o di bromo a un doppio legame C=C si ottiene invece il dialogenuro vicinale:
Il legame Br-Br si polarizza quando si avvicina al sito elettron-ricco costituito dal doppio legame C=C (1); si formano l'intermedio a ponte (bromònio) e l'anione bromuro (2) che attacca l'intermedio dal lato opposto rispetto a quello del ponte per formare il prodotto con stereochimica anti (3).
L'addizione di bromo al butadiene può portare alla formazione di due prodotti, denominati cinetico (1,2) e termodinamico (1,4):
Il prodotto cinetico (1,2) si forma più velocemente, ma il prodotto termonidamico (1,4) è più stabile.
DA ALCHINI. L'addizione di un acido alogenidrico a un triplo legame in rapporto 1:1 porta alla formazione del derivato vinilico: per questa via, un tempo si ricavava il cloruro di vinile monomero (CVM) da acetilene e acido cloridrico.
L'addizione a un triplo legame di un eccesso di acido alogenidrico porta alla formazione del dialogenuro geminale (secondo Markovnikov):
L'addizione a un triplo legame di un eccesso di alogeno porta invece alla formazione di un derivato tetrasostituito:
Nell'esempio, per reazione di acetilene e bromo si forma prima 1,2-dibromo-etilene; questo reagisce con un altro equivalente di bromo per dare 1,1,2,2-tetrabromoetano.
ALTRE VIE. Un'alogenazione di una catena
idrocarburica si ha anche mediante la reazione di Borodin-Hunsdiecker, per
reazione del sale di argento di un acido carbossilico con bromo:
R-COOAg + Br2 -> R-Br + CO2 + AgBr
Altre reazioni simili portano
all'alogenazione di composti carbonilici o di esteri (Hell-Volhard-Zelinsky).
Per l'alogenazione dei sistemi aromatici invece si procede in modo diverso - mediante sostituzione elettrofila
aromatica oppure attraverso diazotazione e poi reazioni di Sandmeyer.
L'alogenazione allilica del benzene, condotta in presenza di luce attinica, porta alla formazione dell'esaclorocicloesano: l'isomero gamma è noto come lindàno, commerciato un tempo come insetticida.
Anche il DDT, altro noto insetticida, è un derivato del cloro-benzene, condensato con il cloralio in presenza di acido solforico, che funge da catalizzatore:
A causa della persistenza nell'ambiente dei derivati clorurati, si è cercato di sostituire questi composti con altri (organofosforici, carbammàti, piretròidi) apparentemente meno impattanti sull'ambiente e sulla salute, nonostante sia necessario riconoscere al DDT un ruolo cruciale nella lotta alla malaria attraverso l'eliminazione del suo principale vettore, la zanzara anofele.








Nessun commento:
Posta un commento